上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息
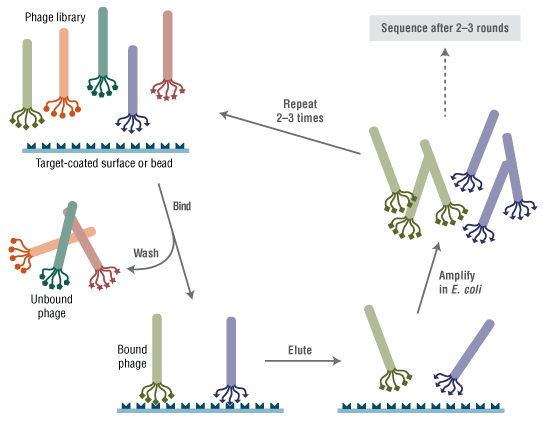
Ph.D.-C7C 噬菌体展示肽库试剂盒 v2 的制备原理是将含有二硫键的环七肽随机肽组合库融合表达于 M13 噬菌体次要外壳蛋白(pIII)的 N 端(5-9)。该库以直接位于野生型 pIII 序列之前的 AC-X7-C-GGG 形式展示。在中性条件下,有利于形成二硫键环。对二硫键环肽库的研究需要是由于,相对于结构不受限制的肽库,对未结合的配体施加结构性限制可能减少靶分子结合时产生的不利结合熵(10-13)。该库包含约 10 亿个电穿孔序列,在提供的 10 μl 噬菌体中经扩增一次,每个序列即可产生约 100 个拷贝。
展示肽形式:AC-X7-C-GGG 野生型 M13 pIII
- 产品类别:
- Protein Tools Products,
- Phage Display Products
- 应用:
- Protein Analysis Tools,
- Phage Display
-
试剂盒组成
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
E8212S Multi-temperature Ph.D.™-C7C Phage Display Peptide Library Kit v2 E8212-1 -20 Ph.D.™-C7C Phage Display Peptide Library E8121AVIAL -20 1 x 0.1 ml 2 x 1013 pfu/ml E. coli K12 ER2738 E4104SVIAL -20 1 x 0.2 ml Not Applicable -96 glll Sequencing Primer (20-mer) S1259AAVIAL -20 1 x 0.05 ml 10 pmol/μl DYKDDDDK Mouse mAb E8004AVIAL -20 1 x 0.015 ml Not Applicable Protein G Magnetic Beads S1430V 4 Protein G Magnetic Beads S1430AVIAL 4 1 x 0.15 ml Not Applicable
-
-
优势和特性
Features
- 对照淘选实验无需执行封闭步骤,可避免噬菌体与塑料结合物发生非特异性结合
- 使用 Protein G 磁珠进行对照淘选实验,可减少繁琐的板/孔冲洗步骤
- 结构限制型库对于靶分子的野生型配体结构中展示有表面环的实验十分有用
- 即用型复杂噬菌体库理论上可以匹配所有可能的 7 个随机结合位点(207 = 1.28 x 109);表型与基因型之间的内在关联支持在单个微孔板或微量离心管中筛选数十亿个克隆
- 无需使用辅助噬菌体进行扩增
- 利用简单明了的分子生物学和无菌培养技术,可在不到一周的时间内获得肽结合序列
- 提供的 -96 gIII 测序引物(500 pmol)可进行 50 次以上测序反应
-
相关产品
相关产品
- Ph.D.™ 多肽展示克隆系统
- PhD-12 噬菌体展示肽库试剂盒 v2
- PhD-7 噬菌体展示肽库试剂盒 v2
单独销售的组分
- e4104-ecoli-k12-er2738
- Protein G 磁珠
-
注意事项
- 若要长期贮存(> 30 天)E. coli K12 ER2738,推荐贮存于 -80℃。
- Protein G 磁珠应贮存于 4℃,以防冻坏。
- 初代试剂盒(NEB #E8120)和二代试剂盒(简称 v2;NEB #E8212)均包含相同的 Ph.D.-C7C 噬菌体展示肽库组份(NEB #E8121)。
- M13 兼容大多数缓冲液条件;不过,洗脱缓冲液可能受制于扩增大肠杆菌所需的培养条件。如果使用二代测序方式,则无需通过扩增来富集噬菌体池。浏览现有文献了解操作流程。
- 在缓冲液(例如 5 mM DTT)中掺入还原剂,可将 Ph.D.-C7C 噬菌体展示肽库转化为线性肽库。该特性也可用于设计淘选后结合研究的对照实验。
- 提供的 -96 gIII 测序引物(500 pmol)可进行 50 次以上测序反应。
-
参考文献
- Sidhu, S.S. (2000). Curr. Opin. Biotechnol.. 11, 610-616.
- O’Neil, K.T. et al. (1992). Proteins. 14, 509-515.
- McLafferty, M.A. et al. (1993). Gene. 128, 26-36.
- Deyle, K. et al . (2017). Acc. Chem. Res. . 50, 1866-1874.
- Chen, Y. et al. (2006). Nat. Biotech.. 24,
- Rodi, D.J. and Makowski, L. (1999). Curr. Opin. Biotechnol.. 10, 87-93.
- Wilson, D.R. and Finlay, B.B. (1998). Can. J. Microbiol.. 44, 313-229.
- Parmley, S.F. and Smith, G.P. (1988). Gene. 73, 305-318.
- Scott, J.K. and Smith, G.P. (1990). Science. 249, 386-390.
- Whaley, S.R. et al. (2000). Nature. 405, 665-668.
- Noren, K.A. and Noren, C.J. (2001). Methods. 23, 169-178.
- Rozinov, M.N. and Nolan, G.P (1998). Chem. Biol.. 5, 509-515.
- Rodi, D.J. et al. (1999). J. Mol. Biol.. 285, 197-203.
操作说明、说明书 & 用法
-
操作说明
- Quick Start Protocol PhD Phage Display Peptide Library Kit v2
- Panning Protocol 1: Solution-phase Panning with Affinity Bead Capture
- Panning Protocol 2: Surface-Phase Panning (Direct Target Coating)
- Phage ELISA Binding Assay with Direct Target Coating
- Phage Titering
- Plaque Amplification for ELISA Samples
- Post Panning Protocol 1: Rapid Purification of Single-Stranded DNA Templates for Sequencing Reactions
-
说明书
产品说明书包含产品使用的详细信息、产品配方和质控分析。- manualE8210_E8211_E8111_E8212
-
应用实例
- Ph.D.™ Peptide Display Cloning System
FAQs & 问题解决指南
-
FAQs
- What is the difference between the original and version 2 (v2) Phage Display kits?
- Which of the three ready-made libraries should I choose?
- What is the difference between the three ready-made libraries?
- Can a different bacterial strain be used with the Ph.D.™ Phage Display?
- No plaques are visible when titering using a Ph.D.™ Phage Display Library.
- I am using Ph.D.™ Phage display and the amplified phage titer is low.
- I am using Ph.D.™ Phage Display and the phage DNA templates do not yield a readable sequence.
- I am using Ph.D.™ Phage Display and the sequencing templates do not run where they should on a gel.
- I am using Ph.D.™ Phage Display and after 4 or more rounds of panning all clones are wild-type phage (white plaques).
- When performing an experiment using Ph.D.™ Phage Display, the ELISA indicates that background binding to the plate is as high as binding to the target.
- When using the Ph.D.™ Phage Display, panning yielded a consensus sequence, but no ELISA signal.
- Where can I find references for Ph.D.™ phage display libraries?
-
问题解决指南
- Phage Display Troubleshooting Guide (NEB #E8210, #E8211, #E8212)
