- 产品特性
- 相关资料
- Q&A
- 参考文献
细胞培养用胶原蛋白
Cellmatrix® Series
|
Cellmatrix是作为细胞培养胶原蛋白开发的。可简单再现各种需要使用胶原蛋白的培养方法。 |
|
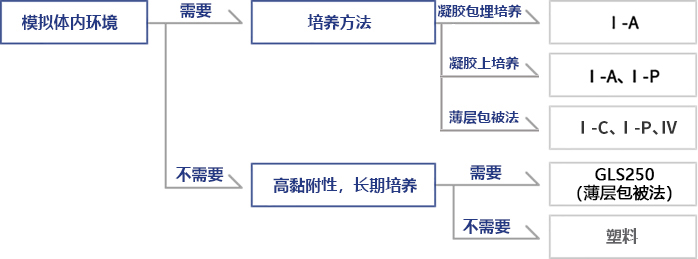
◆Cellmatrix® 系列选择指南(Nitta Gelatin提供)
◆优势、特色
|
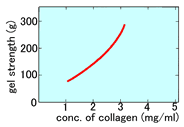
Cellmatrix® Type I-A ● 猪腱由来,酸可溶性的Type-I胶原蛋白 ● 浓度3.0 mg/mL、pH3的无菌溶液 ● 高凝胶强度,适合胶原蛋白・凝胶包埋培养 ● 凝胶的透明度高,容易显微镜观察 |
凝胶透明度的比较
Type I –A是面对3D培养的产品,对凝胶形成速度 以及透明度进行了优化。可以在细胞下沉到培养容 器底部前,迅速地形成凝胶。且凝胶的透明度非常 高,易于观察细胞。 |
|
Cellmatrix® Type I-C
● 猪皮由来的胃蛋白酶可溶化的Type-I胶原蛋白 ● 浓度3.0 mg/mL、 pH3的无菌溶液 ● 低粘度,适合包被 ● 几乎不会凝胶化 |
|
|
Cellmatrix® Type I-P
● 猪腱由来的胃蛋白酶可溶化的Type-I胶原蛋白 ● 浓度3.0 mg/mL、pH3的无菌溶液 ● 粘性低、容易处理 ● 形成凝胶 |
|
|
Cellmatrix® Type Ⅳ
● 用胃蛋白酶处理牛晶状体前囊精制的Type-Ⅳ胶原蛋白 ● 低粘度、适合包被 ● 浓度3.0 mg/mL、pH3的无菌溶液 ● 不会凝胶化 |
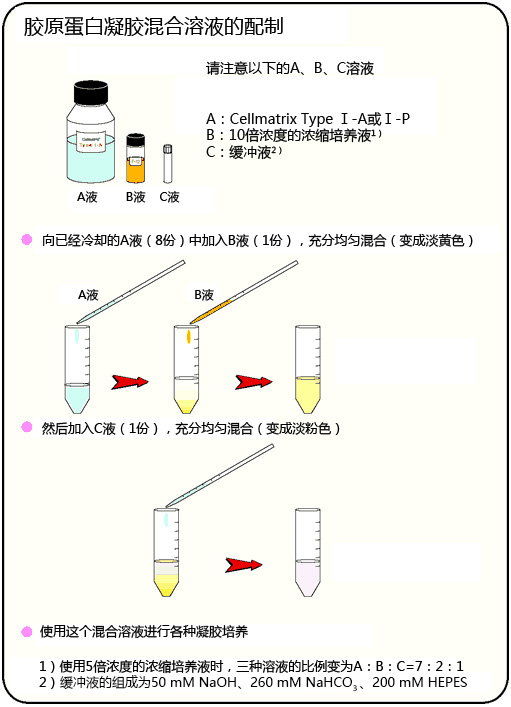
◆胶原蛋白凝胶培养方法
事前准备
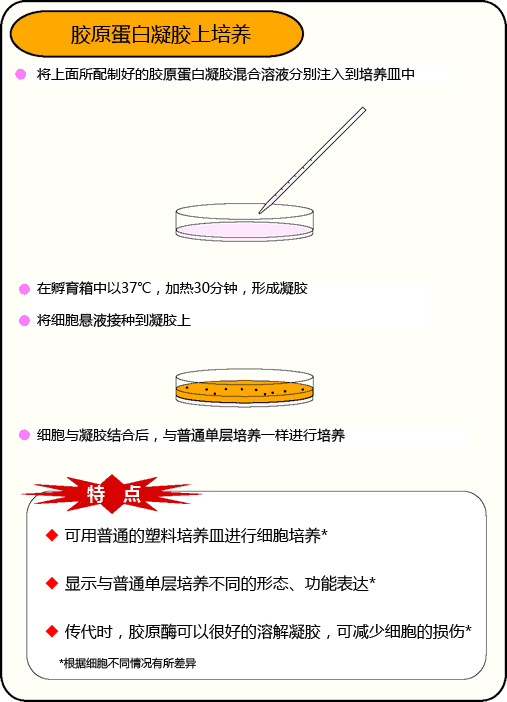
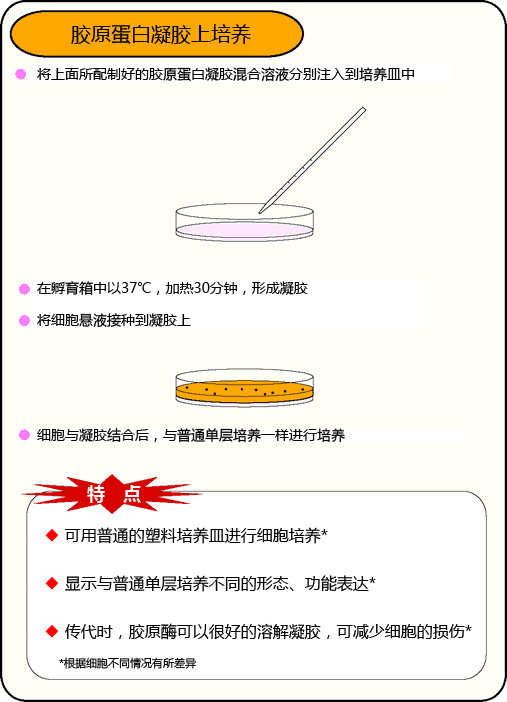
胶原蛋白凝胶上培养
点击此处查看视频版实验操作
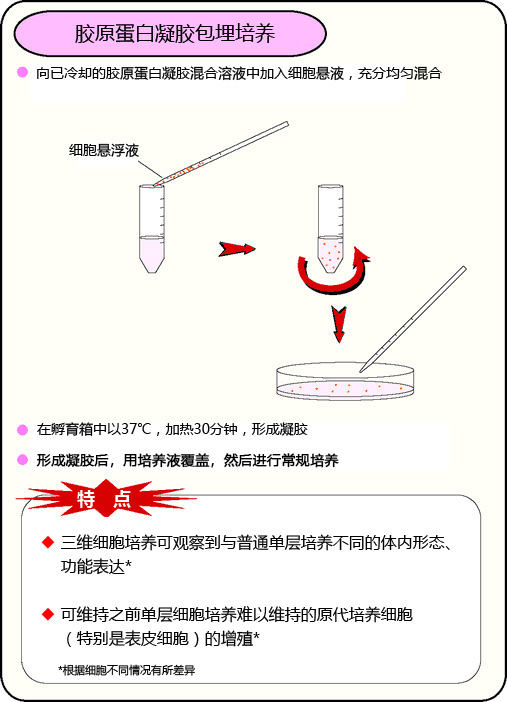
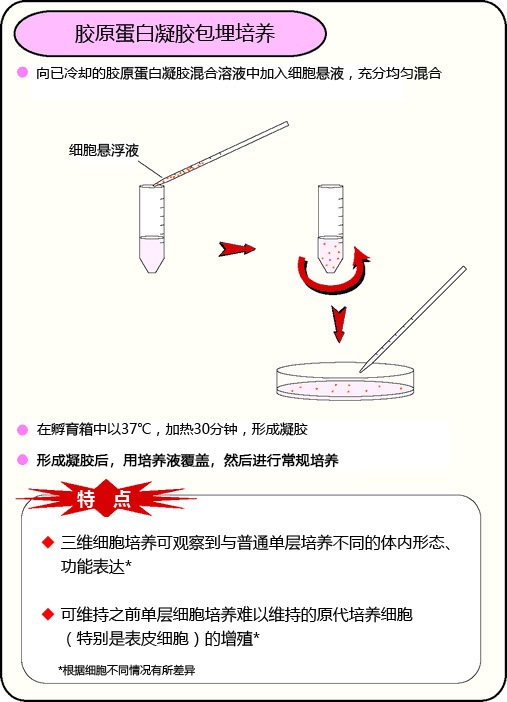
胶原蛋白凝胶包埋培养
点击此处查看视频版实验操作
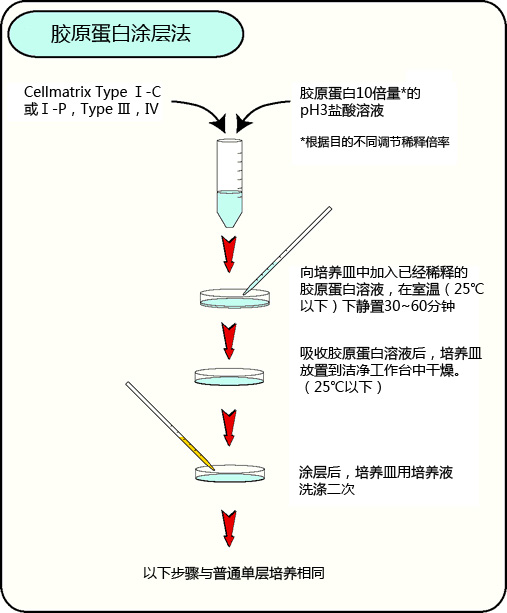
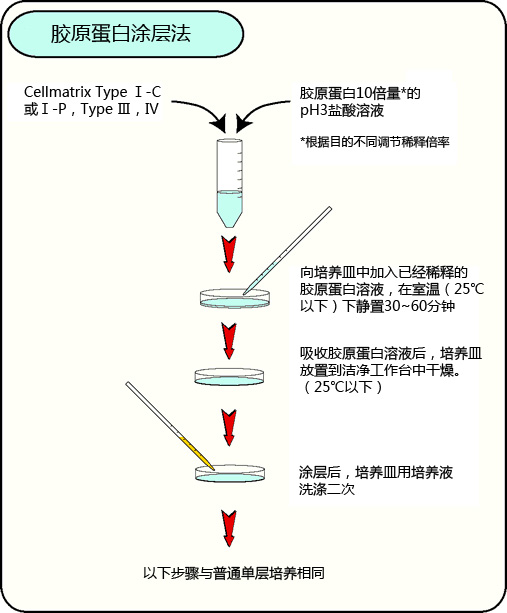
胶原蛋白涂层法
点击此处查看视频版实验操作
◆应用
【Type I-A】
|
经胶原蛋白、凝胶包埋培养的 小鼠乳腺癌细胞增殖形态。 |
Cellmatrix Type I-A具有高凝胶强度 |
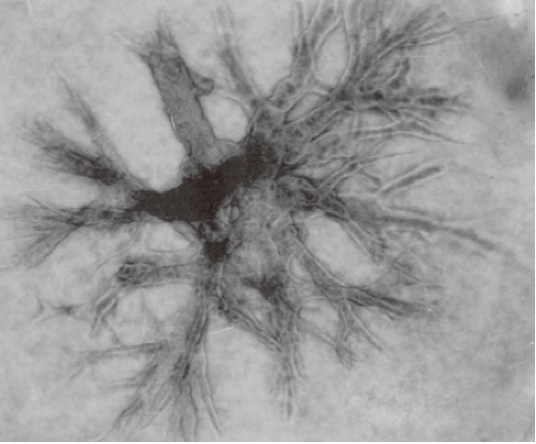 |
|
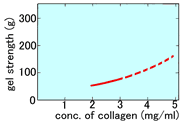
【Type I-P】
Cellmatrix Type I-P可形成比较软的凝胶
【Type I-C】
培养细胞的伸展活性
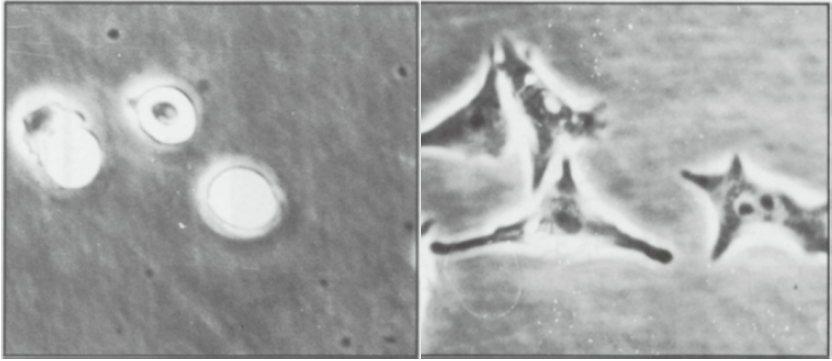
左:未涂布 右:涂布胶原蛋白
彩页下载,请点击:Cellmatrix® 系列 细胞培养级胶原蛋白
【相关资料】
|
Cellmatrix® 胶原蛋白用细胞培养指南 |
Nitta-Gelatin Product Guide |
胶原蛋白凝胶培养方法
事前准备
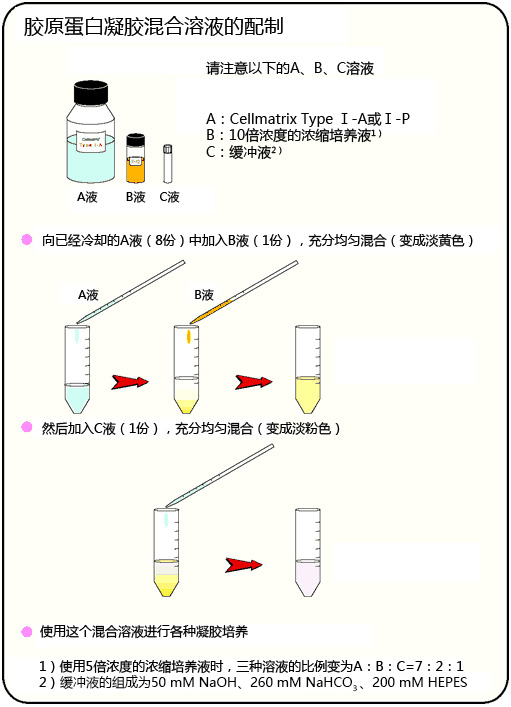
胶原蛋白凝胶上培养
胶原蛋白凝胶包埋培养
胶原蛋白涂层法
Q: 请告知胶原蛋白和明胶的差异。为什么明胶在4℃做凝胶,胶原蛋白在37℃做凝胶?
A: 明胶是胶原蛋白的变性产物,具体地说,胶原蛋白是三股螺旋缠绕的结构,分子量为30万道尔顿,经热等因素而被破坏,形成无规则线圈
结构的蛋白质为明胶。所以明胶和胶原蛋白,一级结构(氨基酸组成)相同,二级结构不同。这个差异反映了胶原蛋白和明胶产生凝胶的
条件差异。
胶原蛋白保持三股螺旋缠绕的结构,在螺旋结构外侧排列着疏水性氨基酸——脯氨酸。胶原蛋白凝胶利用这个疏水性氨基酸,通过<温度
高的一方,具有高结合力>疏水结合,制备明胶。而明胶二级结构被破坏,亲水性氨基酸在外侧排列,通过氢结合和离子结合制作凝胶。
当温度高时,<氢结合力+离子结合力>克服明胶主链的热运动,不形成凝胶。但是,当变为低温时,<氢结合力+离子结合力>成为热运动
力量,明胶形成凝胶。
Q: 用明胶凝胶是否能培养?
A: 用明胶凝胶不能培养。明胶凝胶在37℃的培养条件下不会形成凝胶,将会溶化。
在组织培养液中,明胶的用途一般为:在培养皿中进行明胶涂层培养,或在明胶海绵上用福尔马林等进行桥联培养。
Q: 想购买胶原蛋白凝胶,是否有?
A: 以胶原蛋白溶液的状态作为商品销售。可根据附送的手册,进行胶原蛋白凝胶制作。
请将Cellmatrix Type I-A作为胶原蛋白凝胶培养产品,进行订购。为第一次做胶原蛋白凝胶培养法的顾客,准备了制作凝胶所必须的试剂
套装和胶原蛋白凝胶培养试剂盒。
Q: 为什么溶解于酸性溶液的胶原蛋白能进行培养?
A: 实际上,在胶原蛋白包埋细胞前,需要将酸性的胶原蛋白溶液调整成中性。
调整后的胶原蛋白因为低温保持者溶液状态,以这个状态将细胞悬液混合到胶原蛋白溶液中。
之后,将含有这个细胞的胶原蛋白溶液移到培养皿中,在37℃中加热,胶原蛋白以细胞包埋状态形成凝胶。
这个就是胶原蛋白凝胶包埋培养法的制作方法。
详细请参考在线手册。
Q: Cellmatrix有很多的胶原蛋白种类,应该选哪个才好?
A: 根据目的不同,变化使用的种类。
根据主要目的,将产品系列分成如下种类,请参考。
胶原蛋白凝胶培养试剂盒、Cellmatrix Typr I-A、Cellmatrix TypeI-P适合胶原蛋白凝胶培养法。
其他的Cellmatrix(Cellmatrix Type I-C,III,IV)不能进行胶原蛋白凝胶培养。
Cellmatrix Type I-C适合标准的涂层培养法——胶原蛋白涂层培养法。请根据客人实验的细胞及方法,考虑适合的Cellmatrix ,实验性地
考虑其他类型的胶原蛋白。例如,软骨细胞使用Cellmatrix Type II等,表皮细胞使用Cellmatrix Type IV等。
Q: 为何胶原蛋白凝胶比琼脂凝胶的培养效率好?
A: 请让我简单地说明琼脂培养法和胶原蛋白凝胶培养法的差异。
被包埋在胶原蛋白凝胶内的细胞,在胶原蛋白基质上以贴壁的状态进行增殖。 .
可是,被琼脂包埋的细胞,在琼脂基质上以未贴壁状态进行增殖。所以,贴壁依赖性细胞在胶原蛋白凝胶中进行细胞增殖,在琼脂内不进行
细胞增殖。
有报告指出:贴壁依赖性比较低的癌细胞,采用胶原蛋白凝胶培养法比采用琼脂培养法,显示高倍数的克隆形成率。
有众多报告指出:胶原蛋白凝胶法对细胞增殖、细胞分化的诱导、形态形成等有效。
关于胶原蛋白凝胶培养法的详细报告,请参考主页的论文介绍。
Q: 胶原蛋白凝胶包埋培养法和胶原蛋白、涂层培养法,有什么不同?
A: 胶原蛋白凝胶包埋培养法是在胶原蛋白凝胶内做细胞包埋,进行细胞培养的方法。
被包埋到胶原蛋白内的细胞,和体内一样进行三维增殖。
胶原蛋白涂层培养法是在培养皿上做胶原蛋白薄涂层,然后再上面进行细胞培养的方法,细胞呈单层增殖。
综上所述,胶原蛋白凝胶包埋培养法是作为细胞外基质,利用胶原蛋白的三维培养法:胶原蛋白涂层培养法是利用胶原蛋白作为细胞吸附因
子的二维培养法(单层培养法)。
Q: 想进行胶原蛋白凝胶培养,应该选哪种Cellmatrix才好?
A: 请选Cellmatrix Type I-A。还有为初学者准备的,含有制作胶原蛋白凝胶全部试剂的胶原蛋白凝胶培养试剂盒。
建议第一次使用的人购买这个胶原蛋白凝胶培养试剂盒,试剂盒货号是638-00781。
Q: 想进行胶原蛋白、涂层培养防法,应该选哪种Cellmatrix才好?
A: 请选Cellmatrix Type I-C。Cellmatrix Type I-C具有低粘度,处理容易,适合标准胶原蛋白涂层培养法。
根据细胞种类和培养条件的不同,也能得到更好的适合细胞的胶原蛋白涂层。
例如,表面细胞可使用Cellmatrix Type IV胶原蛋白等。请进行实验研讨。
Q: 想学习胶原蛋白培养法,请介绍合适的论文。
A: 详细请参考在线手册。
该手册详细地介绍了:所谓的胶原蛋白是什么、胶原蛋白培养法的效果、胶原蛋白培养发的具体方法等。
关于论文,请参考主页的论文介绍项目。
Q: 请具体地告知胶原蛋白、凝胶包埋培养方法。
A: 将作为酸性溶液的胶原蛋白溶液Cellmatrix Type I-A调整成中性。
调整后的胶原蛋白因为低温,保持着溶液状态,以这个状态将细胞悬浊液混合到胶原蛋白溶液中。之后江汉油田这个细胞的胶原蛋白溶液
移到培养皿中,在37℃中加热,胶原蛋白以细胞包埋状态形成凝胶。
关于详细 ,请参考在线手册。
Q: 请具体地告知胶原蛋白涂层的方法。
A: 将Cellmatrix Type I-C用稀盐酸(pH 3.0,约10-3 M)稀释10倍以上,放入培养皿中,在室温中静置30~60分钟。
静置后,摄取胶原蛋白溶液,以常温、无菌状态干燥培养皿。干燥后,用PBS或培养液洗涤2次,加入细胞悬液,进行普通培养。
Q: 进行胶原蛋白涂层时,向培养皿注入多少量的胶原蛋白溶液才好?
A: 胶原蛋白溶液注入量为均匀覆盖培养皿底面即可。
以1 mL/10 cm2比例为标准
Q: Cellmatrix Type IV是否能进行包埋培养?
A: 单独使用Cellmatrix Type IV胶原蛋白不能进行包埋培养。众多胶原蛋白中只有I型胶原蛋白具有凝胶化能力。
若想研究在包埋培养下的IV型胶原蛋白与细胞的互相作用,请混合I型胶原蛋白IV型胶原蛋白。Cellmatrix Type I和Cellmatrix Type IV的混
合比例,在1:2~2:1范围为好。混合比例与胶原蛋白凝胶强度的关系,请参考本公司手册<使用胶原蛋白的细胞培养法>。
Q: 所谓的胶原蛋白是不是培养基?
A: 胶原蛋白不是培养基。所谓的胶原蛋白是培养基的基质。
胶原蛋白凝胶是在培养基中作为整体结构支撑体的胶原蛋白组织,相当于生物体中的血液。
在体外的细胞作为胶原蛋白的细胞外基质存在。
将胶原蛋白作为培养基质使用的胶原蛋白凝胶包埋培养,旨在重现生物内环境的状态。
Q: 请告知胶原蛋白的稀释方法。
A: 用pH 3.0稀盐酸稀释。因为胶原蛋白具有高粘性,使用像试管一样的细小容器比较难稀释,使用三角烧瓶或离心管(例如:50 mL培养用
塑料离心管等)等粗的容器比较容易稀释。
三角烧瓶,像画圆一样摇晃10次左右:离心管,来回颠倒10次左右,进行搅拌稀释。如果,出现起泡,可静置一晚后使用,或以低速离心
分离(1500 rpm,3 min)脱气后使用。同时,开发了胶原蛋白、涂层培养用低粘度型的Cellmatrix Type I-C。可一起讨论。
Q: pH3.0盐酸是多少摩尔值?请告知制作方法。
A: pH盐酸是10-3摩尔/升。因为盐酸是强酸,浓度基本合适,调整好pH计,就可快速、正确地制作。
例如,一边用pH仪表测量,一边用巴斯德移液管一滴一滴向100 mL蒸馏水中加入1N的盐酸。
pH3.0盐酸制成后,请以高压灭菌或过滤灭菌。
| 1. |
Matsunaga, M., Hatta, K., Nagafuchi, A., & Takeichi, M. (1988). Guidance of optic nerve fibres by n-cadherin adhesion molecules. Nature, 334(6177), 62-4. 【Cellmatrix® Type I-A. IF:43.07】 |
| 2. |
Morishita, A. , Kumabe, S. , Nakatsuka, M. , & Iwai, Y. . (2014). A histological study of mineralised tissue formation around implants with 3d culture of hms0014 cells in cellmatrix type i-a collagen gel scaffold in vitro. Okajimas Folia Anatomica Japonica, 91(3), 57-71. 【Cellmatrix® Type I-A】 |
| 3. |
Nakao, K., Itoh, M., Tomita, Y., Tomooka, Y., & Tsuji, T. (2004). Fgf-2 potently induces both proliferation and dsp expression in collagen type i gel cultures of adult incisor immature pulp cells. Biochemical & Biophysical Research Communications, 325(3), 1052-1059. 【Cellmatrix® Type I-A. IF:2.705】 |
| 4. |
Udagawa, N., Takahashi, N., Akatsu, T., Tanaka, H., Sasaki, T., & Nishihara, T., et al. (1990). Origin of osteoclasts: mature monocytes and macrophages are capable of differentiating into osteoclasts under a suitable microenvironment prepared by bone marrow-derived stromal cells. Proceedings of the National Academy of Sciences of the United States of America, 87(18), 7260-7264. 【Cellmatrix® Type I-A. IF:9.58】 |
| 5. |
Koide, N., Sakaguchi, K., Koide, Y., Asano, K., Kawaguchi, M., & Matsushima, H., et al. (1990). Formation of multicellular spheroids composed of adult rat hepatocytes in dishes with positively charged surfaces and under other nonadherent environments. Experimental Cell Research, 186(2), 0-235. 【Cellmatrix® Type I-A ,Cellmatrix® Type III,Cellmatrix® Type IV. IF:3.329】 |
| 6. |
Jabaji, Z., Brinkley, G. J., Khalil, H. A., Sears, C. M., Nan, Y. L., & Lewis, M., et al. (2014). Type i collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. Plos One, 9(9), e107814. 【Cellmatrix® Type I-A. IF:2.776】 |
| 7. |
Shakado, S., Sakisaka, S., Noguchi, K., Yoshitake, M., Harada, M., & Mimura, Y., et al. (2010). Effects of extracellular matrices on tube formation of cultured rat hepatic sinusoidal endothelial cells. Hepatology, 22(3), 969-973. 【Cellmatrix® Type I-A,Cellmatrix® Type IV. IF:14.971】 |
| 8. |
Tamura, T., Udagawa, N., Takahashi, N., Miyaura, C., Tanaka, S., & Yamada, Y., et al. (1993). Soluble interleukin-6 receptor triggers osteoclast formation by interleukin 6. Proceedings of the National Academy of Sciences of the United States of America, 90(24), 11924-11928. 【Cellmatrix® Type I-A. IF:9.58】 |
| 9. |
Takahashi, N., Udagawa, N., Akatsu, T., Tanaka, H., Isogai, Y., & Suda, T. (1991). Deficiency of osteoclasts in osteopetrotic mice is due to a defect in the local microenvironment provided by osteoblastic cells*. Endocrinology, 128(4), 1792-1796. 【Cellmatrix® Type I-A. IF:3.8】 |
| 10. |
Mano, H. . (1996). Mammalian mature-osteoclasts as estrogen target cells. Biochemical & Biophysical Research Communications, 223(3), 637-642. 【Cellmatrix® Type I-A. IF:2.705】 |
| 11. |
Udagawa, N., Takahashi, N., Jimi, E., Matsuzaki, K., Tsurukai, T., & Itoh, K., et al. (1999). Osteoblasts/stromal cells stimulate osteoclast activation through expression of osteoclast differentiation factor/rankl but not macrophage colony-stimulating factor: receptor activator of nf-kappa b ligand. Bone, 25(5), 517-523. 【Cellmatrix® Type I-A. IF:4.36】 |
|
12. |
Woo, J. T., Kasai, S., Stern, P. H., & Nagai, K. (2010). Compactin suppresses bone resorption by inhibiting the fusion of prefusion osteoclasts and disrupting the actin ring in osteoclasts. Journal of Bone & Mineral Research, 15(4), 650-662. 【Cellmatrix® Type I-A. IF:5.711】 |
| 13. |
Ishida, K., Murofushi, M., Nakao, K., Morita, R., Ogawa, M., & Tsuji, T. (2011). The regulation of tooth morphogenesis is associated with epithelial cell proliferation and the expression of sonic hedgehog through epithelial–mesenchymal interactions. Biochemical & Biophysical Research Communications, 405(3), 455-461. 【Cellmatrix® Type I-A. IF:2.705】 |
| 14. |
Nakagawa, H. , Wachi, M. , Woo, J. T. , Kato, M. , Kasai, S. , & Takahashi, F. , et al. (2002). Fenton reaction is primarily involved in a mechanism of (?)-epigallocatechin-3-gallate to induce osteoclastic cell death. Biochemical and Biophysical Research Communications, 292(1), 94-101. 【Cellmatrix® Type I-A. IF:2.705】 |
| 15. |
Onodera, K. I., Fukatsu, T., Kawai, N., Yoshioka, Y., Okamoto, T., & Nakamura, H., et al. (2004). Zooxanthellactone, a novel γ-lactone-type oxylipine from dinoflagellates of symbiodinium sp.: structure, distribution, and biological activity. Bioscience Biotechnology & Biochemistry, 68(4), 848-852. 【Cellmatrix® Type I-A. IF:1.297】 |
| 16. |
Torisawa, Y. S., Shiku, H., Yasukawa, T., Nishizawa, M., & Matsue, T. (2005). Multi-channel 3-d cell culture device integrated on a silicon chip for anticancer drug sensitivity test. Biomaterials, 26(14), 2165-2172. 【Cellmatrix® Type I-A. IF:10.273】 |
| 17. |
Murakami, H., Takahashi, N., Tanaka, S., Nakamura, I., Udagawa, N., & Nakajo, S., et al. (1997). Tiludronate inhibits protein tyrosine phosphatase activity in osteoclasts. Bone, 20(5), 399-404. 【Cellmatrix® Type I-A. IF:4.36】 |
| 18. |
Fujimoto, M., & Mihara, S. I. (1991). Two states of the l-type ca 2+ channel in pc12 cells: different sensitivity to 1,4-dihydropyridines. Neuroscience Letters, 122(1), 9-12. 【Cellmatrix® Type I-A. IF:2.173】 |
| 19. |
Kawamura, S., Wakitani, S., Kimura, T., Maeda, A., Caplan, A. I., & Shino, K., et al. (1998). Articular cartilage repair: rabbit experiments with a collagen gel-biomatrix and chondrocytes cultured in it. Acta Orthop Scand, 69(1), 56-62. 【Cellmatrix® Type I-A】 |
| 20. |
Tilney, L. G., Derosier, D. J., & Mulroy, M. J. (1980). The organization of actin filaments in the stereocilia of cochlear hair cells. Journal of Cell Biology, 86(1), 244-259. 【Cellmatrix® Type III,Cellmatrix® Type IV. IF:8.891】 |
| 21. |
Yoshii, C., Ueda, Y., Okamoto, M., & Araki, M. (2007). Neural retinal regeneration in the anuran amphibian xenopus laevis post-metamorphosis: transdifferentiation of retinal pigmented epithelium regenerates the neural retina. Developmental Biology, 303(1), 45-56. 【Cellmatrix® Type I-C. IF:2.936】 |
| 22. |
Aoki, K. , & Matsuda, M. . (2009). Visualization of small gtpase activity with fluorescence resonance energy transfer-based biosensors. NATURE PROTOCOLS, 4(11), 1623-1631. 【Cellmatrix® Type I-C. IF:11.334】 |
| 23. |
Minakawa, M., Miura, Y., & Yagasaki, K. (2012). Piceatannol, a resveratrol derivative, promotes glucose uptake through glucose transporter 4 translocation to plasma membrane in l6 myocytes and suppresses blood glucose levels in type 2 diabetic model db/db mice. Biochemical & Biophysical Research Communications, 422(3), 469-475. 【Cellmatrix® Type I-C. IF:2.705】 |
| 24. |
Koide, T., Homma, D. L., Asada, S., & Kitagawa, K. (2005). Self-complementary peptides for the formation of collagen-like triple helical supramolecules. Bioorganic & Medicinal Chemistry Letters, 15(23), 5230-5233. 【Cellmatrix® Type I-C. IF:2.448】 |
| 25. |
Izuta, H., Shimazawa, M., Tsuruma, K., Araki, Y., Mishima, S., & Hara, H. (2009). Bee products prevent vegf-induced angiogenesis in human umbilical vein endothelial cells. Bmc Complementary & Alternative Medicine, 9(1), 45. 【Cellmatrix® Type I-C. IF:2.479】 |
| 26. |
Umigai, & Naofumi. (2012). Crocetin, a carotenoid derivative, inhibits vegf-induced angiogenesis via suppression of p38 phosphorylation. Current Neurovascular Research, 9(2), 102-109. 【Cellmatrix® Type I-C. IF:1.811】 |
| 27. |
Isaji, M., Miyata, H., Ajisawa, Y., Takehana, Y., & Yoshimura, N. (2010). Tranilast inhibits the proliferation, chemotaxis and tube formation of human microvascular endothelial cells in vitro and angiogenesis in vivo. British Journal of Pharmacology, 122(6), 1061-1066. 【Cellmatrix® Type I-P. IF:6.583】 |
| 28. |
Tokunaga, T., Kiso, T., Namikawa, T., & Ohtsubo, Y. (1999). Camp-independent chloride secretion activated by a vasoactive intestinal peptide in a monolayer culture of human bronchial epithelial cells. Biological & Pharmaceutical Bulletin, 22(7), 745-748. 【Cellmatrix® Type I-C. IF:1.54】 |
| 29. |
Aoki, Y. , Satoh, K. , Sato, K. , & Suzuki, K. T. . (1992). Induction of glutathioner, sr, -transferase p-form in primary cultured rat liver parenchymal cells by co-planar polychlorinated biphenyl congeners. Biochemical Journal, 281(2), 539-543. 【Cellmatrix® Type I-P. IF:4.331】 |
| 30. |
Yamamoto, M., Kato, K., & Ikada, Y. (2015). Ultrastructure of the interface between cultured osteoblasts and surface-modified polymer substrates. Journal of Biomedical Materials Research, 37(1), 29-36. 【Cellmatrix® Type I-P】 |
| 31. |
Ishihara, S., Haga, H. M., Mizutani, T., Kawabata, K., Shirato, H., & Nishioka, T. (2010). Integrin beta1-dependent invasive migration of irradiation-tolerant human lung adenocarcinoma cells in 3d collagen matrix. Biochemical & Biophysical Research Communications, 396(3), 651-655. 【Cellmatrix® Type I-C,Cellmatrix® Type I-P. IF:2.705】 |
| 32. |
Suzuki, M., Ichikawa, K., Sakoda, A., & Sakai, Y. (1993). Long-term culture of primary rat hepatocytes with high albumin secretion using membrane-supported collagen sandwich. Cytotechnology, 11(3), 213. 【Cellmatrix® Type I-P. IF:1.672】 |
| 33. |
Nakaoka, R. , Tsuchiya, T. , Kato, K. , Ikada, Y. , & Nakamura, A. . (1997). Studies on tumor-promoting activity of polyethylene: inhibitory activity of metabolic cooperation on polyethylene surfaces is markedly decreased by surface modification with collagen but not with rgds peptide. Journal of biomedical materials research, 35(3), 391-397. 【Cellmatrix® Type I-P】 |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 |