阿尔茨海默症β-淀粉样蛋白
 神经退行性疾病研究最前线
神经退行性疾病研究最前线
东京大学研究生院药学系研究科 功能病态学课题组 堀 由起子、富田 泰辅
◆序言
何谓β-淀粉样蛋白多肽Aβ
阿尔茨海默症(Alzheimer disease;AD)患者的大脑中,老人斑是最显著的病理特征之一,是不溶性蛋白质异常聚集形成丰富的β片层结构的淀粉样纤维,并积累于脑实质细胞间隙的构成物。 通过近年来开发的淀粉样蛋白PET成像分析人脑内积累的老人斑发现,认知功能障碍症状出现前的10-15年,就能明显看到老人斑的出现,因此老人斑被认为是AD发病过程中的最早期病变。1984年Glenner等人开始研究脑血管淀粉样蛋白,1985年Masters等人开始研究老人斑淀粉样蛋白,对其进行分离纯化和氨基酸测定,证实老人斑的主要构成成分为β-淀粉样蛋白多肽(Aβ)。
Aβ的肽链由约40~43个氨基酸组成。在N末端和C末端分别发生几种变异,老人斑积累的代表性物质Aβ包括由40个氨基酸组成且以40号Val残基结束的Aβ40和由42个氨基酸组成以42号Ala残基结束的Aβ。与Aβ40相比,Aβ42的凝集性非常高,在老人斑形成早期就已经积累起来了。积累的Aβ一部分被修饰,存在3号Glu残基被pyro化修饰的Aβ。
◆淀粉样蛋白假说
AD多数情况下为偶发性病症,但也有极小部分是以常染色体显性遗传的家族性AD(Family AD;FAD)形式存在。从遗传学研究角度鉴定FAD的致病基因——编码Aβ前体蛋白(APP)的APP基因、APP切断酶γ-secretase复合体的活性中心蛋白被PSEN 1和PSEN 2基因编码的Presenilin 1和2识别。在上述3种遗传基因的基础上,对FAD家族进行研究发现FAD变异存在以下病变结果:①Aβ产生总量增加;②高凝集性的Aβ42产生比率增加;③Aβ自体凝集性增强。 由此提出了Aβ的凝集·积累是诱发AD症的“淀粉样蛋白假说”。作为APP基因上的保护性变异,A673T的变异会使Aβ产生减少,由此更强有力地支持了Aβ是AD发病机制的“淀粉样蛋白假说”。
大脑中Aβ的浓度是通过对其产生和清除进行平衡调节,一旦平衡被破坏了,就会出现Aβ在脑内聚集的局面。本文通过Aβ的产生、清除和聚集三方面,靶向治疗Aβ展开论述根治AD的方法。
◆Aβ的产生过程
Aβ是由其前体蛋白APP切断出来的肽链片段。APP是I型单向膜贯通性蛋白质,普遍存在于各个组织中。根据氨基酸剪接不同主要分为695/751/770三种氨基酸类型,但在大脑中发现较多的是695氨基酸的APP695。
在健康的人脑脊髓液中也可检测出Aβ,它并不是AD病患者脑中病变产生的产物,而是APP正常代谢过程中产生、分泌的分子。Aβ是通过对APP 2阶段的剪切后产生的(如图1)。首先,APP的细胞外域被β-secretase切断,细胞外域片段(sAPPβ)被分泌出来。然后γ-secretase切断残留在细胞膜的APP的C末端断片(C99),并产生Aβ和AICD。Aβ的C末端变异是γ-secretase切断时引起的,氨基酸切断的部位不同,可以产生Aβ37到Aβ49等多种Aβ。以前人们瞩目于高产生量的Aβ40,或聚集性·毒性高的Aβ42,但近年来,聚集性·毒性高的Aβ43也备受瞩目。另外,除了γ-secretase的切断抑制作用,对于其切断活性调节的γ-secretase modulator(GSM)的开发和功能机制的研究也在进行中, Aβ37和Aβ38的短Aβ种类的产生机制也受关注。β-secretase的分子形态是以BACE1为活性中心,Aph-1、Pen-2、nicastrin的复合体;γ-secretase是以presenilin 1或presenilin 2为活性中心的,与Aph-1、Pen-2、nicastrin组成的复合体。
APP代谢过程中,除Aβ产生途径外,还存在非Aβ产生途径(如图1)。非Aβ产生途径也分为2个阶段的剪切,第2阶段的剪切酶同样是γ-secretase,但第1阶段的剪切酶为α-secretase。α-secretase是在APP上的Aβ内域16号Lys残基和17号Leu残基间切断的, 产生的约3kDa的片段(p3)是缺失Aβ N末端域16氨基酸的多肽片段。神经细胞中的ADAM10就是主要的α-secretase。
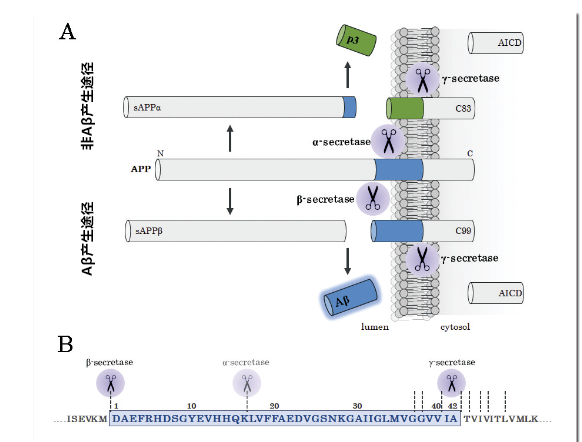
图1. Aβ产生途径和非Aβ产生途径
(A)Aβ产生途径模式图。APP被β-secretase、γ-secrease切断产生Aβ(Aβ产生途径);被α-secretase、γ-secretase切断则产生p3(即非Aβ产生路径)。
(B)Aβ序列及其切断部位图像。蓝色部分表示Aβ序列。
近年来有报道指出,Aβ产生量是随神经活动的变化而变化的。在小鼠脑内可明显观察到,脑部位的神经活动量和Aβ产生量、Aβ积累量相关,小鼠进入睡眠状态时,神经活动受到抑制,Aβ产生量也明显减少14、15)。利用光遗传学技术使神经活动长期处于连续亢奋的状态,则发现Aβ积累量增加16)。虽然通过增强神经活动使Aβ产生的机制尚未明确,但随着神经活动亢奋,内吞作用增强可能使得被运送至细胞表面的APP更容易被内吞作用以及被BACE1切断。
◆Aβ清除过程
通常情况下,可以通过迅速清除脑内产生的Aβ,来维持大脑内Aβ的一定浓度。但是在一部分的FAD患者中,FAD的变异结果使Aβ产生量增加,破坏脑内Aβ平衡,引发AD症。另一方面,在偶发性AD患者群中发现,AD症的突破点不在Aβ产生的增强,而是Aβ的清除17)。这个结果表明除了Aβ产生过程,Aβ清除过程的详细分子机制研究也至关重要。报道指出,Aβ分解酶的分解、胶质细胞的吞噬作用、通过血脑屏障(BBB)的排出输送等都可作为Aβ清除的主要机制。
代表性的Aβ分解酶有:金属蛋白酶——Insulin degrading enzyme(IDE)和Neprilysin(NEP),丝氨酸蛋白酶——Kallikrein-related peptidase 7 (KLK7)等18, 19, 20)。从基因敲除小鼠案例中阐明了二者都能分解小鼠脑内的内源性Aβ,还可以减少AD患者脑内的Aβ量,降低其分解活性。另外,使用腺病毒相关载体表达NEP等也可以减少Aβ的积累21),更表明了这些Aβ分解酶可能成为AD病症治疗的标靶。
脑内的小胶质细胞和星形胶质细胞等胶质细胞吞噬Aβ也被推断出来。在小胶质细胞中,发现了与Aβ吞噬作用有关的scavebger receptor等受体。加之近年来从胶质细胞相关研究发现的可能与AD风险相关基因群(Genome wide association study;GWAS)中,发现小胶质细胞中含有多种高表达的遗传基因22),这些胶质细胞可能以某种形式影响着AD症的发病。实际上,这些遗传基因中,关于CD33和TREM2等对Aβ清除造成的影响已被报道23, 24)。
◆Aβ凝集过程
Aβ单体中,没有特定结构,聚集、积累后Aβ形成了丰富的β片段构造的淀粉样蛋白纤维。Aβ42的聚集性比Aβ40高,是脑内老人斑形成时最先积蓄的一种Aβ。Aβ40比Aβ42结构更容易发生改变,虽然原因暂时不明,但已有报道指出31-34号、38-41号氨基酸残基上组成β发夹结构可稳定C末端结构,使其更易形成β片段结构27)。在Aβ分子内,淀粉样蛋白纤维与25-29号氨基酸组成转角结构形成β片段结构,通过分子间相互作用形成β交叉片段25、26)。组成分子内转角结构的氨基酸域附近是增强Aβ聚集性效果的基因变异集中的热点部位,可从结构侧面推测出这些变异可促进Aβ的结构变化和纤维加速形成。
Aβ形成淀粉样蛋白纤维的过程,可以建立体外实验的核形成过程和伸长过程的模型28)29)。核形成过程就是Aβ单体发生结构变化并发生核纤维伸长形成聚合(seed)的最初过程,是一个缓慢进行的淀粉样蛋白形成过程。Aβ42的这个成核过程比Aβ40要早。持续伸长过程是以形成的seed为起点,Aβ通过结构变化依次结合使纤维快速伸长的过程。在体外,单独孵育Aβ40聚集进展缓慢,预先添加纤维化的Aβ可以加速聚集速度。同样在体内,将AD患者脑来源或带有Aβ积累的AD模型小鼠来源的脑裂解液注入不带Aβ积蓄的小鼠脑中,注入的Aβ作为seed在脑中促进Aβ的积累30)。由此证明了seed形成在Aβ积累中的重要性。上述的AD患者脑来源的Aβ淀粉样蛋白结构分析中,淀粉样蛋白结构并非相同的,病变过程不同的患者可能产生不同的淀粉样蛋白构造,由此也可证明最初形成seed结构的重要性。
初期提到的《淀粉样蛋白假说》提出Aβ积累形成老人斑,是AD症发病的原因。但是,老人斑和认知功能衰退之间并无明确的相关性、比起淀粉样蛋白纤维oligomer等Aβ聚集中间体具有强毒性被明确后,现在已将《特别是聚集中间体发挥着强毒性》作为《淀粉样蛋白假设》的一部分修改形式。Aβ聚集中间体与使淀粉样蛋白纤维构造不溶的Aβ不同,是可溶的低分子量Aβ重组体。有报告指出可溶性中间体在体外试验中有paranuclei、protofibrils、Aβ-derived diffusible ligands(ADDL)等Aβ聚集中间体31)、32)、33)。在体内,除了dimer和trimer等low-n oligomer外,还检测到用12-mer组成的56kDa的Aβ34、35)。这些Aβ凝集中间体的共同性是带有强烈的突触功能障碍和细胞毒性,其形成机制和性质很耐人寻味。
◆以Aβ为治疗靶点的AD根本治疗法
以《淀粉样蛋白假说》为立足点,人们提出各种以Aβ为治疗标靶的AD根本治疗法。主要是①抑制Aβ产生、②促进Aβ清除、③抑制Aβ聚集为目的研究,虽然经过基础实验水平探索、检测了一些候补化合物,但以下记载的两个观点是专门进行临床实验的。
第一是以抑制Aβ产生的各个secretase活性抑制法。但是γ-secretase除了含有APP外还有各种切断底物,特别是切断Notch会造成很大副作用。因此不能使用γ-secretase抑制剂,而是寻求开发以调节切断活性为目的的,可特异性减少Aβ42产生的γ-secretase modulator(GSM)。另外,作为β-secretase的BACE1、BACE1敲除小鼠没有出现presenilin敲除小鼠的异常表现型,β-secretase切断限制Aβ产生过程,因此BACE1抑制剂有望成为AD治疗的有效药物。
第二是促进Aβ清除。这个观点在临床实验中有抗Aβ抗体被动免疫法和Aβ疫苗主动免疫法。1999年,Schenk等人提出了在APP转基因小鼠体内免疫Aβ聚集,可以减少脑内Aβ积累的报告36)。之后还提出注射抗Aβ抗体,可也达到同样效果37),通过抗Aβ抗体也可以促进Aβ清除。尽管清除机制尚未完全明确,但是可认为活化了小胶质细胞活对Aβ的吞噬作用,促进Aβ向末梢延伸。对极少量抗体转移至脑内和抗体表位引起的效果差异,仍需要详细的机制说明。
这些以Aβ为目标的治疗药正在临床实验的困境之中,而造成这个局面的原因之一是治疗开始的时间太晚。前面所提到的老人斑是在认知功能障碍显现的10~15年前就开始积蓄,对表现出认知功能障碍且已演变为AD病症的患者,单纯以Aβ为目标的治疗策略不一定能改善AD症状。因此可在Aβ积累开始的未发病期或早期的临床前阶段进行预防性干预,开展预防性医疗38、39)。为了使治疗策略有效执行,必须开发Aβ积累的早期诊断方法,如开发简便的Aβ淀粉样蛋白图像诊断法和生物标记法等。
◆结语
从多年来对AD相关基础研究结果看,将Aβ作为AD发病原因的“淀粉样蛋白假设”和以Aβ为靶标的治疗策略有一定的合理性。但尚不能作为AD根本治疗方法,需要进一步对影响AD症的Aβ做详细的分子机制及临床应用研究。
【参考文献】
[1] Glenner, G. G. et al. : Biochem. Biophys. Res. Commun., 120, 885-890 (1984)
[2] Masters, C. L. et al. : Proc. Natl. Acad. Sci. USA, 82, 4245-4249 (1985).
[3] Iwatsubo, T. et al. : Neuron, 13, 45-53 (1994).
[4] Saido, T. C. et al. : Neuron, 14, 457-466 (1995).
[5] Selkoe, D. J. and Hardy, J. : EMBO Mol. Med., 8, 595-608 (2016).
[6] Jonsson, T.et al. : Nature, 488, 96-99 (2012).
[7] Ponte, P. et al. : Nature, 331, 525-527 (1988).
[8] Tanzi, R. E. et al. : Nature, 331, 528-530 (1988).
[9] Kitaguchi, N. et al. : Nature, 331, 530-532 (1988).
[10] Haass, C. et al. : Nature, 359, 322-325 (1992).
[11] Seubert, P. et al. : Nature, 359, 325-327 (1992).
[12] Qi-Takahara, Y. et al. : J. Neurosci., 25, 436-445 (2005).
[13] Saito, T. et al. : Nat. Neurosci., 14, 1023-1032 (2011).
[14] Kang, J. E. et al. : Science, 326, 1005-1007 (2009).
[15] Bero, A. W. et al. : Nat. Neurosci., 14, 750-756 (2011).
[16] Yamamoto, K. et al. : Cell Rep., 11, 859-865 (2015).
[17] Mawuenyega, K. G. et al. : Science, 330, 1774 (2010).
[18] Iwata, N. et al. : Nat. Med., 6, 143-150 (2000).
[19] Qiu, W. Q. et al. : J. Biol. Chem., 273, 32730-32738 (1998).
[20] Kidana, K. et al. : unpublished
[21] Iwata, N. et al. : Sci. Rep., 3, 1472 (2013).
[22] Lambert, J. C. et al. : Nat. Genet., 45, 1452-1458 (2013).
[23] Griciuc, A. et al. : Neuron, 78, 631-643 (2013).
[24] Wang, Y. et al. : Cell, 160, 1061-1071 (2015).
[25] Petkova, A. T. et al. : Proc. Natl. Acad. Sci. USA, 99, 16742-16747 (2002).
[26] Lu, J. X. et al. : Cell, 154, 1257-1268 (2013).
[27] Sgourakis, N. G. et al. : J. Mol. Biol., 368, 1448-1457 (2007).
[28] Come, J. H. et al. : Proc. Natl. Acad. Sci. USA, 90, 5959-5963 (1993).
[29] Jarrett, J. T. et al. : Biochemistry, 32, 4693-4697 (1993).
[30] Meyer-Luehmann, M. et al. : Science, 313, 1781-1784 (2006).
[31] Walsh, D. M. et al. : J. Biol. Chem., 272, 22364-22372 (1997).
[32] Bitan, G. et al. : Proc. Natl. Acad. Sci. USA, 100, 330-335 (2003).
[33] Lambert, M. P. et al. : Proc. Natl. Acad. Sci. USA, 95, 6448-6453 (1998).
[34] Shankar, G. M. et al. : Nat. Med., 14, 837-842 (2008).
[35] Lesne, S. et al. : Nature, 440, 352-357 (2006).
[36] Schenk, D. et al. : Nature, 400, 173-177 (1999).
[37] Bard, F. et al. : Nat. Med., 6, 916-919 (2000).
[38] Sperling, R. et al. : Neuron, 84, 608-622 (2014).
[39] Reiman, E. M. et al. : Nat. Rev. Neurol., 12, 56-61 (2016)
◆Aβ相关试剂
日本和光有Aβ相关试剂产品系列。
抗体
|
产品 编号 |
产品名称 |
克隆号 |
抗原表位 |
子类 |
适用实验 |
与Aβ肽的反应性 |
规格 |
容量 |
|||||
|
人 |
小鼠/大鼠 |
||||||||||||
|
Aβ1-40 |
Aβ1-42 |
Aβ1-43 |
Aβ1-40 |
Aβ1-42 |
Aβ1-43 |
||||||||
|
017-26871 |
Anti Human Amyloid β, Monoclonal Antibody(BAN50) 抗人β-淀粉样蛋白, 单克隆抗体(BAN50) |
BAN50 |
Aβ N末端1-16 |
小鼠 IgG1·κ |
WB/IHC /IP/ELISA |
○ |
○ |
○ |
× |
× |
× |
免疫 化学用 |
10μL |
|
013-26873 |
50μL |
||||||||||||
|
014-26881 |
Anti Amyloid β, Monoclonal Antibody (BNT77) 抗淀粉样蛋白β, 单克隆抗体(BNT77) |
BNT77 |
Aβ11-28 |
小鼠 IgA·κ |
IHC/IP /ELISA |
○ |
○ |
○ |
○ |
○ |
○ |
免疫 化学用 |
10μL |
|
010-26883 |
50μL |
||||||||||||
|
018-26921 |
Anti Amyloid β40, Monoclonal Antibody(BA27) 抗β-淀粉样蛋白40, 单克隆抗体(BA27) |
BA27 |
Aβ40 C末端 |
小鼠 IgG2a·κ |
WB/IHC /ELISA |
○ |
× |
× |
○ |
× |
× |
免疫 化学用 |
10μL |
|
014-26923 |
50μL |
||||||||||||
|
014-26901 |
Anti Amyloid β42(43), Monoclonal Antibody(BC05) 抗β-淀粉样蛋白42(43), 单克隆抗体(BC05) |
BC05 |
Aβ42 C末端 |
小鼠 IgG1·κ |
WB/IHC /ELISA |
× |
○ |
○ |
× |
○ |
○ |
免疫 化学用 |
10μL |
|
010-26903 |
50μL |
||||||||||||
欲了解更多相关产品请点击文字:
抗淀粉样蛋白β抗体(BAN50/BA27/BC05)
淀粉样蛋白β-蛋白免疫组织染色试剂盒
β-Amyloid ELISA 试剂盒
