上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息
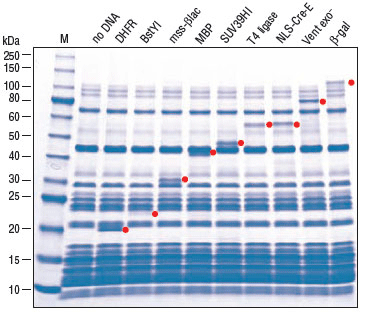
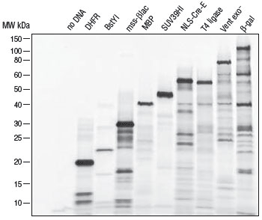
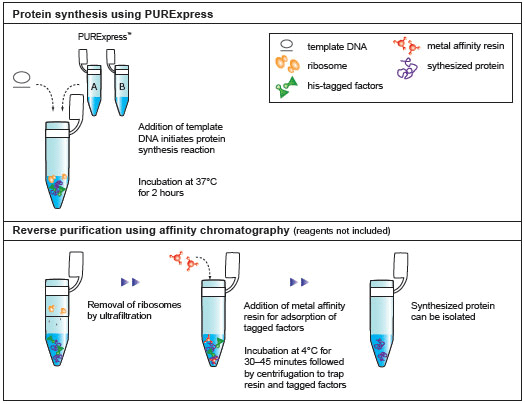
PURExpress® 体外蛋白合成试剂盒是新型无细胞转录/翻译体系,用于基因快速表达分析,是由大肠杆菌翻译所必需组份纯化而构成。PURExpress 体系无核酸酶和蛋白酶的污染,保护了 DNA 和 RNA模板/复合体,避免了蛋白的修饰及降解。转录和翻译过程仅需将两管试剂混合,一步反应即可完成,几个小时内即可获得实验结果,PURExpress 体系大大地节省了宝贵的实验时间,是用于高通量技术的理想选择。
PURExpress 文献引用
- 产品类别:
- PURExpress,
- Cell-Free Protein Expression Products,
- Protein Expression Products
- 应用:
- PURExpress,
- Cell-Free Protein Expression,
- Protein Expression
-
试剂盒组成
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
E6840S -80 PURExpress Solution A (-aa, tRNA) B6841AVIAL -80 1 x 0.05 ml 5 X E. coli tRNA (25 μl) N6842AVIAL -80 1 x 0.025 ml Not Applicable Amino Acid Mix (25 μl) N6843AVIAL -80 1 x 0.025 ml Not Applicable Solution B P6840AVIAL -80 1 x 0.075 ml Not Applicable PURExpress Control DHFR Plasmid N0424AVIAL -20 1 x 0.01 ml 125 ng/µl
-
-
特性和用法
需要但不提供的材料
- 一般条件:37℃温育
- 标记:35S-甲硫氨酸(建议 > 1000 Ci/mmol,体外翻译级)
- TCA 沉淀:TCA 溶液(25%、10%)、1 M NaOH、酪胺酸、乙醇、玻璃纤维过滤器、真空过滤歧管
- SDS-PAGE:凝胶和电泳缓冲液、凝胶装置、电源、凝胶干燥器
- 蛋白免疫印迹法:转移装置、膜、抗体和检测试剂
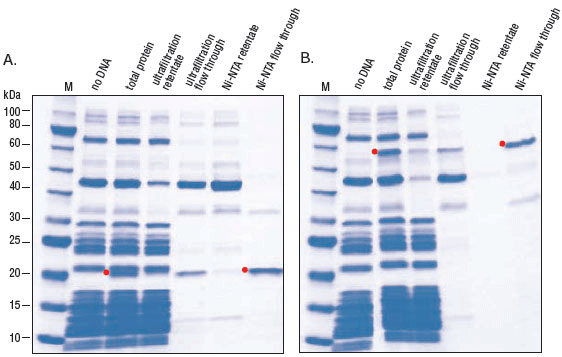
- 纯化:Ni-NTA 琼脂糖、Amicon Ultra- 0.5 ml、Ultracel- 100K 膜离心过滤器
-
优势和特性
应用特性
- 快速合成用于蛋白质特性研究的分析量级别的样本
- 确认开放阅读框
- 检测突变对 ORF 的影响
- 合成具有活性和功能域的截短蛋白
- 掺入修饰的、非天然的或标记的氨基酸
- 绘制抗原表位图谱
- 毒性蛋白表达
- 核糖体展示
- 翻译和/或蛋白折叠研究
- 体外区域化
-
相关产品
相关产品
- PURExpress® Δ RF123 试剂盒
- PURExpress® 体外蛋白合成试剂盒
- PURExpress® 二硫键增强剂
- 小鼠 RNase 抑制剂
- PURExpress® Δ Ribosome 试剂盒
- E. coli 核糖体
-
注意事项
- 阳性对照反应中,加入 2 μl 的对照(DHFR)模板以及氨基酸混合液和 tRNA 各 2.5 μl。
- 每个试剂盒提供的试剂足够进行 10 次反应(25 µl 反应体系/次)。
该试剂盒单独提供氨基酸和 tRNA,用户可通过在反应中加入经修饰的氨基酸和 tRNA 混合液进行蛋白质合成反应。 - 将溶液 B 加入溶液 A 中,不要在未缓冲的情况下稀释溶液 B。我们建议 25 μl 反应体系中模板 DNA 的起始量为 250 ng 。可以通过建立多个反应并滴定加入不同起始量的 DNA,来确定模板 DNA 的最佳用量。通常情况下,每 25 μl 反应体系中,模板 DNA 的最佳用量范围在 25 – 1000 ng 之间。
- PURExpress DHFR 对照模板序列文件:Fasta、GenBank
- 提供 125 ng/μl 的对照(DHFR)模板。使用 2 μl 进行阳性对照反应。模板 DNA,特别是通过质粒小提制备的 DNA(如 Qiagen)通常是 RNase 酶污染的主要来源。我们强烈建议在每个反应中加入 20 单位的小鼠 RNase 抑制剂(NEB #M0314)。
-
参考文献
- Martínez, A. K., E. Gordon, et al. (2013). Interactions of the TnaC nascent peptide with rRNA in the exit tunnel enable the ribosome to respond to free tryptophan. Nucleic Acids Research. 42(2), 1245-56. PubMedID: 24137004
- Horiya S, Bailey J.K., Krauss I.J. (2017). Directed Evolution of Glycopeptides Using mRNA Display.. Methods in Enzymology. DOI: 10.1016/bs.mie.2017.06.029 PubMedID: 28935113
- Houwman J.A., André E, Westphal A.H., van Berkel W.J., van Mierlo C.P. (2016). The Ribosome Restrains Molten Globule Formation in Stalled Nascent Flavodoxin.. The Journal of Biological Chemistry. 291 (50), 25911-25920. DOI: 10.1074/jbc.M116.756205 PubMedID: 27784783
- Huang W.P., Cho C.P., Chang K.Y. (2018). mRNA-Mediated Duplexes Play Dual Roles in the Regulation of Bidirectional Ribosomal Frameshifting.. International Journal of Molecular Sciences. 19 (12), 3867. DOI: 10.3390/ijms19123867 PubMedID: 30518074
- Martínez A.K., Gordon E, Sengupta A, Shirole N, Klepacki D, Martinez-Garriga B, Brown L.M., Benedik M.J., Yanofsky C, Mankin A.S., Vazquez-Laslop N, Sachs M.S., Cruz-Vera L.R. (2014). Interactions of the TnaC nascent peptide with rRNA in the exit tunnel enable the ribosome to respond to free tryptophan.. Nucleic Acids Research. 42 (2), 1245-1256. DOI: 10.1093/nar/gkt923 PubMedID: 24137004
- Seefeldt A.C., Graf M, Perebaskine N, Nguyen F, Arenz S, Mardirossian M, Scocchi M, Wilson D.N., Innis C.A. (2016). Structure of the mammalian antimicrobial peptide Bac7(1–16) bound within the exit tunnel of a bacterial ribosome. Nucleic Acids Research. 44 (5), 2429-2438. DOI: 10.1093/nar/gkv1545 PubMedID: 26792896
- Seefeldt A.C., Nguyen F., Antunes S, Perebaskine N, Graf M, Arenz S, Inampudi K.K., Douat C, Guichard G, Wilson D.N., Innis C.A. (2015). The proline-rich antimicrobial peptide Onc112 inhibits translation by blocking and destabilizing the initiation complex.. Nature Structural and Molecular Biology. 22 (6), 470-475. DOI: 10.1038/nsmb.3034 PubMedID: 25984971
- Starosta A.L., Lassak J, Peil L, Atkinson G.C., Virumäe K, Tenson T, Remme J, Jung K, Wilson D.N. (2014). Translational stalling at polyproline stretches is modulated by the sequence context upstream of the stall site.. Nucleic Acids Research. 42 (16), 10711-10719. DOI: 10.1093/nar/gku768 PubMedID: 25143529
- Ude S, Lassak J, Starosta A.L., Kraxenberger T, Wilson D.N., Jung K (2013). Translation elongation factor EF-P alleviates ribosome stalling at polyproline stretches.. Science. 339 (6115), 82-85. DOI: 10.1126/science.1228985 PubMedID: 23239623
- Wensel D, Sun Y, Li Z, Zhang S, Picarillo C, McDonagh T, Fabrizio D, Cockett M, Krystal M, Davis J (2017). Discovery and Characterization of a Novel CD4-Binding Adnectin with Potent Anti-HIV Activity.. Antimicrobial Agents and Chemotherapy. 61 (8), DOI: 10.1128/AAC.00508-17 PubMedID: 28584151
- Xian F, Li S, Liu S (2015). Rapid biosynthesis of stable isotope-labeled peptides from a reconstituted in vitro translation system for targeted proteomics.. Methods in Enzymology. 565, 347-366. DOI: 10.1016/bs.mie.2015.07.013 PubMedID: 26577738
- Ude, S., J. Lassak, et al. (2013). Translation Elongation Factor EF-P Alleviates Ribosome Stalling at Polyproline Stretches. Science. 339(6115), 82-5. PubMedID: 23239623
- Zukher I, Novikova M, Tikhonov A, Nesterchuck M.V., Osterman I.A., Djordjevic M, Sergiev P.V., Sharma C.M., Severinov K (2014). Ribosome-controlled transcription termination is essential for the production of antibiotic microcin C.. Nucleic Acids Research. 42 (19), 11891-11902. DOI: 10.1093/nar/gku880 PubMedID: 25274735
- Arenz S, Bock L.V., Graf M, Innis C.A., Beckmann R, Grubmüller H, Vaiana A.C., Wilson D.N. (2016). A combined cryo-EM and molecular dynamics approach reveals the mechanism of ErmBL-mediated translation arrest.. Nature Communications. 7, 12026. DOI: 10.1038/ncomms12026 PubMedID: 27380950
- Cui Z, Stein V, Tnimov Z, Mureev S, Alexandrov K (2015). Semisynthetic tRNA Complement Mediates in vitro Protein Synthesis. Journal of the American Chemical Society. 137 (13), 4404-4413.
- Doerfel L.K., Wohlgemuth I, Kubyshkin V, Starosta A.L., Wilson D.N., Budisa N, Rodnina M.V. (2015). Entropic Contribution of Elongation Factor P to Proline Positioning at the Catalytic Center of the Ribosome. Journal of the American Chemical Society. 137 (40), 12997-13006. DOI: 10.1021/jacs.5b07427 PubMedID: 26384033
- Fleming S.R., Bartges T.E., Vinogradov A.A., Kirkpatrick C.L., Goto Y, Suga H, Hicks L.M., Bowers, A.A. (2019). Flexizyme-Enabled Benchtop Biosynthesis of Thiopeptides.. Journal of the American Chemical Society. 141 (2), 758-762. DOI: 10.1021/jacs.8b11521 PubMedID: 30602112
- Gan Q, Fan C Increasing the fidelity of noncanonical amino acid incorporation in cell-free protein synthesis. Biochimica et Biophysica Acta – General Subjects. 3047-3052. DOI: 10.1016/j.bbagen.2016.12.002 PubMedID: 27919800
- Glover W.B., Mash D.C., Murch S.J. (2014). The natural non-protein amino acid N-beta-methylamino-L-alanine (BMAA) is incorporated into protein during synthesis. Amino Acids. 46 (11), 2553-2559.
- Hamadani K.M., Howe J, Jensen M.K., Wu P, Cate J.H.D., Marquee S (2017). An in vitro tag-and-modify protein sample generation method for single-molecule fluorescence resonance energy transfer.. The Journal of Biological Chemistry. 292 (38), 15636-15648. DOI: 10.1074/jbc.M117.791723 PubMedID: 28754692
操作说明、说明书 & 用法
-
操作说明
- Protein Synthesis Reaction using PURExpress® ∆ (aa, tRNA) Kit (E6840)
- Analysis of Synthesized Protein using PURExpress (E6840)
- Measurement of 35S-Methionine Incorporation by TCA Precipitation and Yield Determination using PURExpress
- Determination of Protein Synthesis Yield with PURExpress (E3313, E6800, E6840, E6850)
- Purification of Synthesized Protein using Reverse His-tag Purification
-
说明书
产品说明书包含产品使用的详细信息、产品配方和质控分析。- manualE6800_E3313_E6840_E6850
-
应用实例
- Scaling down to scale up Miniaturizing cell free protein synthesis reactions with the Echo 525 Acoustic Liquid Handler
工具 & 资源
-
选择指南
- Protein Expression and Purification Selection Chart
FAQs & 问题解决指南
-
FAQs
- How is the Δ aa Δ tRNA Kit E6840S different from the PURExpress E6800S kit?
- When using PURExpress, I was unable to synthesize the control protein?
- When using PURExpress, I was able to synthesize the target protein, but full-length product is not major species?
- When using PURExpress, I was able to synthesize the control protein, but the target sample is not present or present in low yield?
- Where can I find many more detailed FAQs for PURExpress?
- Are there PURExpress citations?
-
实验技巧
- 在冰上融化试剂和建立反应体系
使用前,请将溶液 A 和 B 充分混合。不要涡旋溶液 B 或核糖体,将其轻轻混合。
溶液 A 可能呈浑浊白色。以均匀悬浮状态加入到反应中。
在冰上按下列加样顺序建立反应体系:溶液 A、溶液 B、RNAse 抑制剂、水、模板 DNA 或 RNA
建立反应体系后,要确保所有试剂都充分混合,可以轻柔地上下吸打混匀并进行短暂瞬时离心,37℃条件下温育 2 到 4 小时。 - 在冰上融化试剂和建立反应体系
