上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息
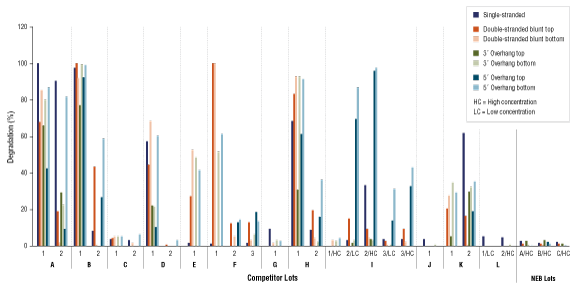
重点
- 从重组酶中分离
- 随附 10X 反应缓冲液
产品来源
大肠杆菌菌株,携带有 T4 DNA 连接酶基因。
- 产品类别:
- DNA Ligases Products
- 应用:
- BioBrick® Assembly,
- Cloning Ligation,
- NEBridge® Golden Gate Assembly
-
产品组分信息
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
M0202V -20 T4 DNA Ligase M0202VVIAL -20 1 x 0.025 ml 400,000 units/ml T4 DNA Ligase Reaction Buffer B0202SVIAL -20 1 x 1 ml 10 X
-
M0202S -20 T4 DNA Ligase M0202SVIAL -20 1 x 0.05 ml 400,000 units/ml T4 DNA Ligase Reaction Buffer B0202SVIAL -20 1 x 1 ml 10 X
-
M0202T -20 T4 DNA Ligase M0202TVIAL -20 1 x 0.01 ml 2,000,000 units/ml T4 DNA Ligase Reaction Buffer B0202SVIAL -20 1 x 1 ml 10 X
-
M0202L -20 T4 DNA Ligase M0202LVIAL -20 1 x 0.25 ml 400,000 units/ml T4 DNA Ligase Reaction Buffer B0202SVIAL -20 1 x 1 ml 10 X
-
M0202M -20 T4 DNA Ligase M0202MVIAL -20 1 x 0.05 ml 2,000,000 units/ml T4 DNA Ligase Reaction Buffer B0202SVIAL -20 1 x 1 ml 10 X
-
-
特性和用法
单位定义
1 单位是指在 20 µl 反应体系,1X T4 DNA 连接酶反应缓冲液中,16℃ 条件下 30 分钟内能使 50% 的经 HindIII 消化的 λ DNA 片段 [DNA 5´ 末端浓度为 0.12 µM (300 μg/ml)] 连接所需的酶量。
浓度:
400,000 粘性末端单位/ml 和 2,000,000 粘性末端单位/ml反应条件
1X T4 DNA 连接酶反应缓冲液
Incubate at 16°C1X T4 DNA 连接酶反应缓冲液
50 mM Tris-HCl
10 mM MgCl2
1 mM ATP
10 mM DTT
(pH 7.5 @ 25°C)贮存溶液
10 mM Tris-HCl
50 mM KCl
1 mM DTT
0.1 mM EDTA
50% Glycerol
pH 7.4 @ 25°C热失活
65°C for 10 minutes
-
优势和特性
应用特性
- 限制性酶切片段的克隆
- 将连接子(linkers)和接头(adapters)连接到 DNA 片段的平末端
-
相关产品
相关产品
- 快速末端平齐化™ 试剂盒
- Monarch® DNA 胶回收试剂盒
- Monarch® PCR & DNA 纯化试剂盒(5 μg)
- t1010-monarch-plasmid-miniprep-kit
单独销售的组分
- T4 DNA 连接酶反应缓冲液
-
注意事项
- ATP 是反应中必不可少的辅因子。这与需要 NAD 作为辅因子的 E. coli DNA 连接酶不同。
- 若需稀释 T4 DNA 连接酶,推荐使用含 50% 甘油的贮存缓冲液(稀释缓冲液 A,NEB #B8001S)稀释,然后于 -20℃ 贮存。如稀释后立即使用,也可以使用 1X T4 DNA 连接酶反应缓冲液稀释。
- 连接反应可以在添加 1 mM ATP 的四种限制性内切酶缓冲液的任何一种或在 T4 多聚核苷酸激酶(T4 PNK)缓冲液中进行。
- 室温连接
为方便起见,连接可在室温(20 – 25℃)条件下进行。连接粘性末端,在 20 µl 反应体系中加入 1 µl T4 DNA 连接酶,反应 10 分钟。连接平末端,在 20 µl 的反应体系中加入 1 µl 的 T4 DNA 连接酶,反应 2 小时;或者加入 1 µl 高浓度的 T4 DNA 连接酶反应 10 分钟。此外,也可选择 NEB Quick Ligation 快速连接试剂盒(#M2200S)[30 次反应] 或(#M2200L)[150 次反应]),在室温条件下反应 5 分钟,即可完成 DNA 平末端和粘性末端的连接。
-
参考文献
- Engler, M.J. and Richardson, C.C. (1982). P.D. Boyer(Ed.), 5, 3. San Diego: Academic Press.
- Remaut, E., Tsao, H. and Fiers, W. (1983). Gene. 22, 103-113.
- Sambrook, J., Fritsch, E.F. and Maniatis, T. (1989). Molecular Cloning: A Laboratory Manual, (2nd Ed.). 1.53-1.73.
操作说明、说明书 & 用法
-
操作说明
- Ligation Protocol with T4 DNA Ligase (M0202)
- Golden Gate (24 Fragment) Assembly Protocol
-
使用指南
- Activity of DNA Modifying Enzymes in rCutSmart™ Buffer
- Tips for Maximizing Ligation Efficiencies
-
应用实例
- Breaking through the Limitations of Golden Gate Assembly
- Efficient Adaptor Ligation for the Preparation of dsDNA Libraries using the Blunt/TA Ligase Master Mix
- Generating Oligonucleotide Probes using Immobilized T4 DNA Ligase minimizes sample loss and saves time
工具 & 资源
-
选择指南
- DNA Ligase Selection Chart
- NEB Diluent and Buffer Table
- Properties of DNA and RNA Ligases
- Substrate-based Ligase Selection Chart
-
Web 工具
- NEBcloner®
- NEBioCalculator®
FAQs & 问题解决指南
-
FAQs
- What are some potential problems with the ligation reaction using T4 DNA Ligase that can lead to transformation failure?
- What are some other problems that should be considered when trouble shooting a transformation problem?
- What problems can be encountered in the restriction digest that can cause ligation using T4 DNA Ligase or subsequent transformation to fail?
- What controls should be run to test the cells and DNA when using T4 DNA Ligase?
- When should T4 DNA Ligase be the enzyme of choice?
- Can the T4 DNA Ligase be used with the Quick Ligase buffer?
- What is the definition of a Weiss Unit and a Cohesive End Unit?
- What is the difference between the two definitions and why does NEB use the Cohesive End Unit?
- How much DNA should be used in a ligation using T4 DNA Ligase?
- Can T4 DNA Ligase be used in other NEBuffers, including rCutSmart?
- Can T4 DNA Ligase be heat inactivated?
-
问题解决指南
- Troubleshooting Tips for Ligation Reactions
