上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品信息
*冰箱的实际内部温度会有所不同。我们的测试表明,酶和缓冲液在 -20℃ 条件下仍保持液体状态。
**电转连接酶还可用于化学感受态大肠杆菌菌株。与平末端/TA 连接酶预混液(NEB #M0367)相比,其连接效率通常约为 50%。
产品来源
从大肠杆菌菌株中纯化获得,其携带有编码 T4 DNA 连接酶的重组基因。
- 产品类别:
- DNA Ligases Products
- 应用:
- Cloning Ligation
-
产品组分信息
本产品提供以下试剂或组分:
NEB # 名称 组分货号 储存温度 数量 浓度 -
M0369S -20 ElectroLigase® M0369SVIAL -20 1 x 0.05 ml Not Applicable ElectroLigase® Reaction Buffer B0369SVIAL -20 1 x 0.25 ml 2 X
-
-
特性和用法
热失活
65°C for 15 minutes
-
优势和特性
应用特性
- 载体构建
- 连接子连接
- 片段组装
- 文库构建
- TA 克隆
-
相关产品
相关产品
- t1010-monarch-plasmid-miniprep-kit
- Monarch® DNA 胶回收试剂盒
- Monarch® PCR & DNA 纯化试剂盒(5 μg)
-
注意事项
- 用法说明:
细胞: 感受态细胞的效率可能相差几个数量级。观察到的连接效率与用于转化的感受态细胞效率有直接关系。转化未切割载体作为对照,以用于比较。
DNA: 用于连接的纯化 DNA 可溶于 dH2O(推荐使用 Milli-Q® 水或同等纯度的水);也可使用 TE 或其它稀释缓冲液。为实现最佳连接效果,须添加 20 – 100 ng 的载体 DNA 及 3 倍摩尔量的插入片段。若连接体积大于 11 μl,则相应增加电转连接酶反应缓冲液的体积。对于单片段插入,插入片段与载体的最佳比例为 2:1 至 6:1。低于 2:1 就会导致较低的连接效率,高于 6:1 则会导致多片段插入。如果无法确定 DNA 浓度,请以不同的比例进行多个平行的连接。
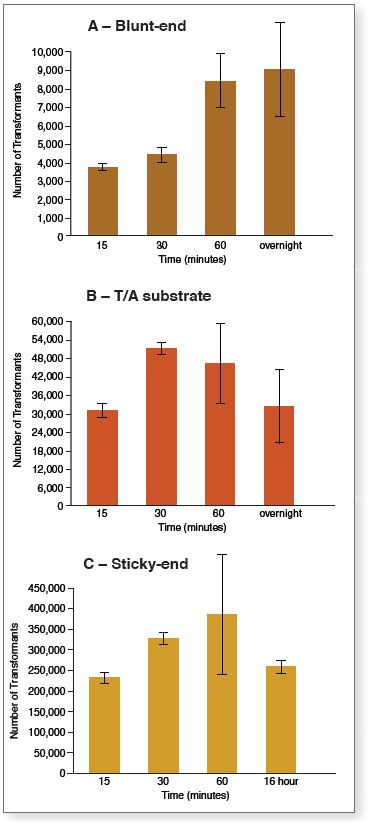
时间和温度: 大多数使用电转连接酶在 4 – 37℃ 范围内进行的连接,会在 60 分钟以内到达终点。温育时间过长并不会提高连接效率 在对 4℃、16℃、25℃ 及 37℃ 条件下的性能进行评估后,我们建议在 25℃(室温)条件下温育。多数情况下均可在 30 分钟内达到 50% 的连接效率。
生物学特性: 某些 DNA 序列不易克隆。大肠杆菌会倾向于丢失形成结构的 DNA 序列,包括反向重复序列和串联重复的序列。大肠杆菌无法耐受某些重组蛋白,因此可能会导致转化率较差或菌落数较小。
- 用法说明:
操作说明、说明书 & 用法
-
操作说明
- Ligation Protocol for Cloning with ElectroLigase® (M0369)
- Transformation Protocol (M0369)
-
使用指南
- Tips for Maximizing Ligation Efficiencies
工具 & 资源
-
选择指南
- DNA Ligase Selection Chart
- Properties of DNA and RNA Ligases
-
Web 工具
- NEBcloner®
- NEBioCalculator®
FAQs & 问题解决指南
-
FAQs
- My transformations using ElectroLigase® reactions produced no colonies. What happened?
- Can ligation reactions set-up with ElectroLigase® be used for transformation of chemically competent cells?
- Do I need to dilute the ElectroLigase® reaction in order to use it to transform electrocompetent cells?
- Can ElectroLigase® reactions be incubated for longer than 30 minutes?
- Can I incubate an ElectroLigase® ligation reaction at a temperature other than 25°C?
- I used an ElectroLigase® reaction to transform electrocompetent cells and I experienced arcing of my sample. What happened?
-
问题解决指南
- Troubleshooting Tips for Ligation Reactions
